“9. Sınıf Sonuç Yayınları Kimya Ders Kitabı Sayfa 133 Cevabı” ise önce sorular yazıldı daha sonra kitabın üzerinde çözülerek gösterildi. Önce sorular hemen ardından ise cevaplar mevcuttur.
9. Sınıf Sonuç Yayınları Kimya Ders Kitabı Sayfa 133 Cevabı
1. Kimyasal türler nelerdir? Kimyasal türleri açıklayarak her birine birer örnek veriniz.
Cevap: Doğada bulunan bütün maddeler tanecikli yapıdadır. Maddenin özelliğini gösteren en küçük yapıtaşları olan taneciklere kimyasal tür denir.
- Atom: Bir elementin tüm özelliklerini taşıyan en küçük yapıtaşına atom denir. Elementlerin bir kısmı doğada atomlar halinde bulunurken, bir kısmı da element molekülleri ya da bileşikler halinde bulunurlar.
- İyon:Elektron sayısı ve proton sayısı arasında fark bulunan atomlara iyon denir. Pozitif yüklü iyonlara katyon, negatif yüklü iyonlara anyon denir. Pozitif yüklü iyonlarda proton sayısı elektron sayısından fazla, negatif yüklü iyonlarda ise elektron sayısı proton sayısından fazladır.
- Molekül:Element atomlarından bir kısmı kararsız elektron yapılarını kararlı hale getirebilmek için kendi atomları arasında ya da başka element atomları ile elektron ortaklaşması kurarak kovalent bağ oluştururlar. En az iki atomun kovalent bağ yaparak oluşturdukları nötr atom gruplarına molekül denir.
- Redikal:Ortaklanmamış elektron bulunduran atom, iyon, ya da moleküllere serbest radikal denir. Radikal halde bulunan maddeler kararlı hale geçmedikleri için kimyasal tepkimeye girme istekleri çok fazladır.
2. Kimyasal etkileşim türlerini sınıflandırarak her bir sınıfa ait birer örnek veriniz.
- Cevap:
Kimyasal türler dört sınıfa ayrılır:
Atomlar,
Moleküller,
İyonlar,
Radikaller.
Bu dört sınıf arasındaki etkileşimler genel olarak ikiye ayrılır:
1)Güçlü etkileşimler
2)Zayıf etkileşimler
Eğer bir kimyasal türü ayrıştırmak için 40 kJ/mol’den daha büyük bir enerji gerekirse bu moleküller arasında güçlü etkileşimler olduğu anlamına gelir. Bu güçlü etkileşimler iyonik bağ, kovalent bağ ve metalik bağdır.
Eğer bir kimyasal türü ayrıştırmak için 40 kJ/mol’den daha küçük bir enerji gerekirse bu moleküller arasında zayıf etkileşimler olduğu anlamına gelir. Bu zayıf etkileşimler hidrojen bağları, van der wals bağları (dipol-dipol, iyon-dipol, indüklenmiş dipol) olarak bilinirler.
3. Mg atomunun atom numarası 12, Cl atomunun atom numarası 17’dir. Bu iki atom arasındaki etkileşimde oluşacak kimyasal bağın türü ve oluşumunu açıklayınız.
- Cevap: İyonik bağ
4. N atomunun atom numarası 7’dir. İki N atomu arasındaki etkileşimde oluşacak kimyasal bağın türünü ve oluşumunu açıklayınız.
- Cevap: Apolar kovalent bağ
5. Aşağıda formülleri verilen iyonik bileşiklerin sistematik adlandırılmasını, sistematik adlandırması verilen iyonik bileşiklerin formüllerini yazınız.
- Cevap:

6. Aşağıda formülleri verilen kovalent bileşiklerin sistematik adlandırmasını, sistematik adlandırması verilen kovalent bileşiklerin formüllerini yazınız.
- Cevap:

7. Metalik bağın oluşumunu açıklayınız.
- Cevap: Aynı periyotta sağa doğru gidildikçe metal atomları arasında, metalik bağ kuvveti artar, erime noktası yükselir. Aynı grupta yukarı doğru gidildikçe metalatomları arasında, metalik bağ kuvveti artar, erime noktası yükselir. Elektron denizinde serbest dolaşan değerlik elektron sayısı arttıkça metalik bağ kuvveti artar.
Metalik Bağlı Maddelerin Özellikleri
- Aynı periyotta sağa doğru gidildikçe metal atomları arasında, metalik bağ kuvveti artar, erime noktası yükselir.
- Aynı grupta yukarı doğru gidildikçe metal atomları arasında, metalik bağ kuvveti artar, erime noktası yükselir.
- Elektron denizinde serbest dolaşan değerlik elektron sayısı arttıkça metalik bağ kuvveti artar.
- Metalik bağ metallerin elektrik akımını iletmesini, tel ve levha haline gelmesini ve işlenebilir olmasını sağlar.
- Metaller gelen ışığı yansıttığı için parlaktır.
- Oda şartlarında cıva hariç katı hâlindedirler. Cıva oda koşullarında sıvı hâldedir.
8. Bağ enerjisi nedir? Kimyasal bir bağın oluşma şartlarını açıklayınız.
Cevap: Bağ Enerjisi; atom çekirdeklerini, atomları ya da molekülleri, kendilerini oluşturan yapı taşlarına ayırmak, bunlardan bir ya da birkaç taneciği koparmak için gerekli olan enerjidir. Bir elektronu bağlı olduğu atomdan koparabilmek için gerekli en küçük enerji, o elektronun bulunduğu yörüngedeki bağ enerjisini verir. Aynı biçimde bir atom çekirdeğini, kendisini oluşturan taneciklere (nükleon) ayırabilmek için de belirli bir enerji gerekir. Bu enerji çekirdeğin bağ enerjisidir.
Bağ enerjisi, elektronları atoma bağlayan ya da tanecikleri çekirdek içinde bir arada tutan kuvvetlerin bir ölçüsüdür. Çekirdek kuvvetleri, elektronları atoma bağlayan kuvvetlerden çok büyük olduğu için çekirdeğin bağ enerjisi, elektronların bağ enerjisinden daha büyüktür. Çekirdeklerin bağ enerjisi, genellikle nükleon (proton ve nötron) başına düşen ortalama bağ enerjisiyle ölçülür. Nükleon başına ortalama bağ enerjisi ise, çekirdek bağ enerjisinin çekirdekteki toplam nükleon sayısına bölünmesiyle bulunur. Nükleon başına düşen ortalama bağ enerjisi, hidrojenden başlayarak kütle sayısı arttıkça, hızla artar. Çekirdeklerin bağ enerjisi “kütle eksildiği” denilen bir büyüklükle de ölçülür. Einstein’ın kütleyle enerji arasındaki eşdeğerlilik ilkesine göre, kütle eksikliğine eşdeğer olan enerji, çekirdeğin bağ enerjisini verir. Bir çekirdeği kendisini oluşturan taneciklere ayırmak için çekirdeğin bağ enerjisi kadar bir enerjiye gerek vardır. Çekirdek gerekli sayıda taneciklerin bir araya getirilmesiyle oluşturulsaydı, aynı büyüklükte enerji açıkta kalırdı. Bu bakımdan atom ya da çekirdeklerin bağ enerjisi, atom enerjisinin kaynağını oluştur.
Aşağıda verilen ikili kimyasal türleri, bu kimyasal türler arasında gerçekleşecek kimyasal etkileşim türleri ile eşleştiriniz. (Periyodik tablodan elementlerin hangi sınıfa ait olduğuna bakınız.)
- Cevap:
a. İyonik bağ (4)
b. Dipol-dipol etkileşimi (7)
c. Polar kovalent bağ (8)
ç. London kuvvetleri (6)
d. Apolar kovalent bağ (1)
e. İyon-dipol etkileşimi (5)
f. Hidrojen bağı (2)
g. Metalik bağ (3) 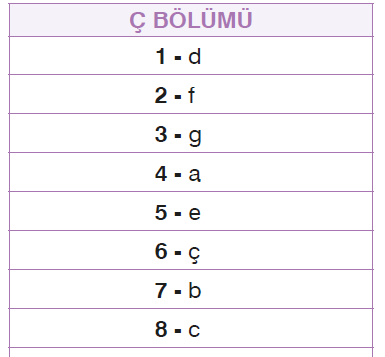
“9. Sınıf Kimya Ders Kitabı Cevapları Sonuç Yayınları Sayfa 133” ile ilgili aşağıda bulunan emojileri kullanarak duygularınızı belirtebilir aynı zamanda sosyal medyada paylaşarak bizlere katkıda bulunabilirsiniz.




















