9. Sınıf Kimya Ders Kitabı Sayfa 134 Cevapları Evrensel İletişim Yayınları’na ulaşabilmek ve dersinizi kolayca yapabilmek için aşağıdaki yayınımızı mutlaka inceleyiniz.
9. Sınıf Kimya Evrensel İletişim Yayınları Ders Kitabı Cevapları Sayfa 134
D) Aşağıdaki soruları cevaplayınız.
1. Tabloda verilen kimyasal türleri atom, iyon veya molekül olarak belirleyiniz. (1H, 7N, 8O, 20Ca)
- Cevap:

2. NH3 ile PH3, H2O ile H2S kimyasal tür çiftlerinin Lewis yapılarını yazınız. Bulundurdukları güçlü ve zayıf etkileşimleri karşılaştırınız. (1H, 7N, 8O, 15P, 16S)
- Cevap:

3. CH4, HCI ve H2O bileşiklerinde, fiziksel bir özellik olan kaynama noktasını belirleyen zayıf etkileşimler hangileridir? Açıklayınız. (1H, 6C, 8O, 17Cl)
- Cevap:
CH4
Etkileşim türü: London Kuvvetleri
CH4, SiH4, GeH4 ve SnH4 molekülleri apolar karakterlidir. Kendi molekülleri arasında sadece London kuvvetleri bulunduğundan diğer gruplardaki bileşiklere göre kaynama noktaları düşüktür.
H2O
Etkileşim türü: London Kuvvetleri, dipol dipol etkileşimleri ve hidrojen bağları
Moleküller arasındaki çekim kuvvetleri ne kadar büyük olursa bileşiğin erime noktası, kaynama noktası gibi fiziksel özellikleri de o kadar yüksek olur. Sadece London kuvvetleri bulunduran bileşiklerde genelde kaynama noktaları düşük, London kuvvetleri ve dipol-dipol etkileşimlerini birlikte bulunduran bileşiklerde ise daha büyüktür. London kuvvetleri, dipol-dipol etkileşimleri ve hidrojen bağlarını içeren bileşiklerde ise genelde beklenenden daha yüksek kaynama noktaları çıkar.
HCI
Etkileşim türü: Dipol-dipol etkileşimleri
Polar bir molekül olan HCl molekülünde molekül içi bağlar, polar kovalent bağdır. Molekülün polar karakterinden dolayı moleküller arasında dipol – dipol etkileşimleri oluşur.Bir moleküldeki polarlık ne kadar fazla ise diğer moleküllerle arasında oluşan dipol-dipol etkileşimi o kadar büyük olur. Dipol-dipol etkileşiminin artması ile bileşiğin erime veya kaynama noktası da artar.
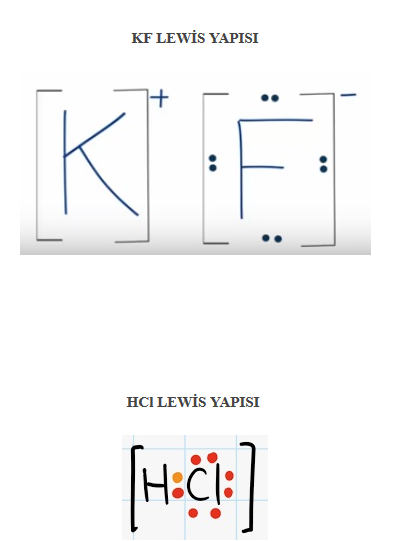
4. Tabloda verilen kimyasal türlerin Lewis yapılarını gösteriniz. (1H, gF, 11Na, CI, 1gK).
- Cevap:

5. İyonik bağlı bileşiklerin genel özelliklerini açıklayınız. İyonik bir bileşiğin suda çözünmesi, türler arasındaki hangi çekim kuvvetlerinin oluşması ile gerçekleşir?
- Cevap:
İyonik bileşiklerin genel özellikleri
1- İyonik bileşiklerin formüllerinde gösterilen birimler molekül hâlinde bulunmaz, iyonik örgü yapısında bulunur.
2- İyonik bileşiklerin erime noktaları genelde çok yüksektir.
3- İyonik bileşiklerin tamamı oda koşullarında (25°C, 1 atm) katı haldedir. Bunun için genelde iyonik katılar olarak anılırlar. Dövüldüklerinde parçalanırlar ve genelde sudaki çözünürlükleri yüksektir.
4-İyonik bileşiklerin katıları elektriği iletmezken sıvı halleri ve sulu çözeltileri elektriği iletir.
5- Kristaller oluştururlar.
6- İyi bir izolatörlerdir.
İyonik bir bileşik suda iyonlarına ayrışarak çözünür. Bu çözünme sonucunda pozitif yüklü sodyum iyonlar ve negatif yüklü iyonlar oluşur. Türlerin molekülleri arasında iyon-dipol etkileşimleri gerçekleşir.
6. 19K, S, 3Li ve 8O element atomlarını aynı periyotta ve aynı grupta olmalarına göre sınıflandırınız.
- Cevap:
➜ 19K 4 1A 1
➜ 16S 3 6A 16
➜ 3Li 2 1A 1
➜ 8O 2 6A 16
Aynı periyotta olanlar: 8O ve 3Li aynı periyottadır. (2. periyot)
Aynı Grupta olanlar: 16S ve 8O 16. grupta, 19K ve 3Li 1. gruptadır.
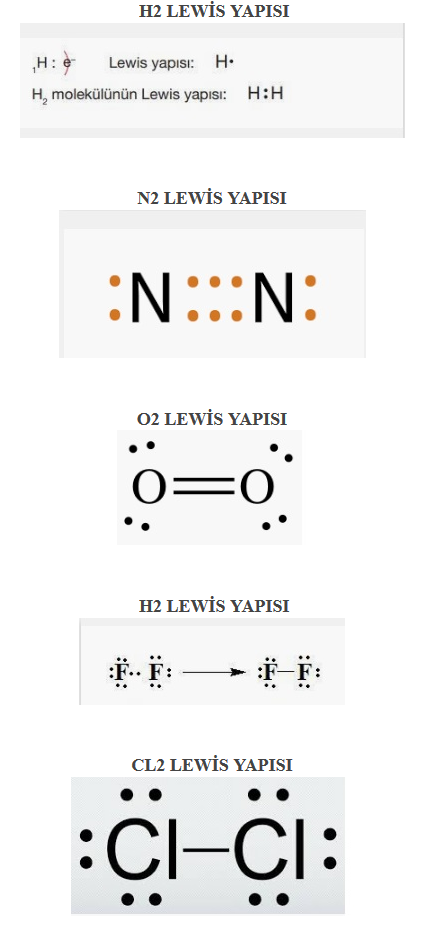
7. H2, N2, O2, F2, CI2 moleküllerinin Lewis yapılarını gösteriniz. Bağların türünü ve polarlığını belirtiniz. Güçlü etkileşimleri tekli, ikili veya üçlü bağ olarak sınıflandırınız (1H, 7N, 8O, 9F, 17CI).
- Cevap:
8. Fiziksel bir değişimdeki ısı enerjisi değişimi kimyasal bir değişimdekinden büyük olabilir mi? Açıklayınız.
- Cevap: Fiziksel değişimde maddelerin sadece fiziksel özellikleri değişir. Parçalanma, kırılma, hal değişim olayları vb. fiziksel değişimlerdir. Fiziksel değişime örnek olarak aşağıdaki olaylar verilebilir. Kağıdın yırtılması, Mumun erimesi, Camın kırılması, Buzun erimesi vb. Maddelerin fiziksel özellikleri fiziksel değişimle değişirken, kimyasal özelliklerinde herhangi bir değişim gözlenmez. Fiziksel değişimlerin oluşması çoğunlukla zayıf çekim kuvvetlerinin kopması ya da ortaya çıkmasıyla gerçekleşir. Kimyasal değişimlerde iyonik bileşik ya da kovalent bileşikteki atomlar arasındaki etkileşimlerin kopması ya da oluşması güçlü etkileşimlerdir. Bu nedenle bu etkileşimlerin gerçekleşmesi sırasında enerji değişimleri çoğunlukla 40 kJ/mol’den büyük olur. Örnek olarak, suyun elektrolizi verilebilir.
9. Zayıf çekim kuvvetlerinden London kuvvetleri, dipol – dipol etkileşimleri ve hidrojen bağlarının kimyasal türün fiziksel özelliklerinde hangi durumlarda etkin olduklarını açıklayınız.
- Cevap: London kuvvetleri, indüklenmiş dipol ile indüklenmiş dipol etkileşimleridir. Geçici dipollerin oluşumu asal gazlar ve apolar yapılı kovalent moleküllerin katı ya da sıvı hâllerinde gerçekleşir. London kuvvetleri, meydana gelen bu geçici dipoller arasındaki çekim kuvvetine verilen isimdir. London kuvvetleri bulunduran bileşiklerde Kaynama noktası düşüktür. London kuvvetlerini ve dipol-dipol etkileşimlerini birlikte bulunduran bileşiklerde Kaynama noktası daha büyük olur. London kuvvetleri, dipol-dipol etkileşimleri ve hidrojen bağlarını içeren bileşiklerde Çok daha yüksek kaynama noktası bulunur. Bir bileşiğin kaynama noktası, erime noktası vb. fiziksel özelliklerinin yüksek olması, moleküller arasındaki çekim kuvvetlerinin büyüklüğüyle doğru orantılıdır. Bir moleküldeki polarlık ile diğer moleküllerle arasında meydana gelen dipol-dipol etkileşimi doğru orantılıdır. Bir molekülün polarlığının yüksek olması dipol dipol etkileşiminin de yüksek olmasını sağlar. Bir bileşiğin erime ya da kaynama noktasının artması Dipol-dipol etkileşiminin artmasıyla gerçekleşir.
10. Magnezyum metalinin erimesi, LPG’nin yanması, yemek tuzunun suda çözünmesi ve sodyum metalinin suda çözünmesi değişimlerini fiziksel ve kimyasal olmalarına göre sınıflandırınız.
- Cevap:
1. Magnezyum metalinin erimesi: Katı haldeki magnezyum metalinin erimesiyle metal sadece fiziksel değişime uğrar. Maddenin kimyasal yapısında bir değişim gerçekleşmez. Bu nedenle magnezyum metalinin erimesi fiziksel bir olaydır.
2. LPG’nin yanması: Yanma olaylarının hepsi maddenin kimyasal yapısında değişim meydana getirdiği için kimyasal değişimlerdir. Saf maddelerin ya da çözeltilerin elektrolizi, çürüme, küflenme vb. olaylar da yine kimyasal değişimdir. LPG’nin yanması kimyasal bir olaydır.
3. Yemek tuzunun suda çözünmesi: Yemek tuzunun suda çözünmesi fiziksel bir olaydır. Tuz sadece suda erimiştir, tuzun kimyasal yapısında bir değişim meydana gelmez.
4. Sodyum metalinin suda çözünmesi: Sodyum metalinin suda çözünmesiyle birlikte ortaya Sodyum Hidroksit (NaOH) ve hidrojen gazı (H) açığa çıkar. Bu maddeler yeni birer madde olduğu için sodyum metalinin suda çözünmesi kimyasal bir olaydır.
9. Sınıf Evrensel İletişim Yayınları Kimya Ders Kitabı Sayfa 134 Cevabı ile ilgili aşağıda bulunan emojileri kullanarak duygularınızı belirtebilir aynı zamanda sosyal medyada paylaşarak bizlere katkıda bulunabilirsiniz.




















