“9. Sınıf Sonuç Yayınları Kimya Ders Kitabı Sayfa 81 Cevabı” ise önce sorular yazıldı daha sonra kitabın üzerinde çözülerek gösterildi. Önce sorular hemen ardından ise cevaplar mevcuttur.
9. Sınıf Sonuç Yayınları Kimya Ders Kitabı Sayfa 81 Cevabı
1. Dalton atom modelini açıklayarak günümüzde bu modelin geçerli ya da geçersiz olan yönlerini belirtiniz.
- Cevap:
1. Atomlar içi dolu küreler değildir. Atomun büyük bir kısmı elektronların içinde dolaştığı boşluktan oluşur.
2. Belli bir elementin bü*tün atomları birbirinin aynıdır görüşü hatalıdır. Atomların izotopları vardır.
3. Atomlar parçalanamaz yenide oluşturulamaz fikri yanlıştır. Günümüzde nükleer değişmelerle atomlar parçalanabilmekte ve yeniden oluşturulabilmektedir.
4. Atom altı parçacıkların (elektron,proton,nötron)
varlığından hiç bahsetmemesi önemli bir eksikliktir.
5. Elektronların farkında olmadığı için kimyasal bağın oluşumu ile ilgili günümüze ait MODERN BAĞ KAVRAMI bu teori ile açıklanamaz.
2. Rutherford, gözlemlediği altın levha deneyinin sonucuna göre nasıl bir atom modeli açıklamıştır?
- Cevap:
➜ α- ışınlarının bir çoğu altın levhadan geçtiğine göre atom içerisinde büyük boşluklar var demektir.
➜ Atom kütlesinin tamamına yakını ve pozitif yüklerin tamamı çekirdekte toplanmıştır. Çekirdeğin hacmi çok küçüktür.
➜ Çekirdekteki pozitif yükün miktarı elementler arasında farklılık gösterir. Çekirdek kütlesinin yaklaşık olarak yarısını protonlar oluşturur.
➜ Çekirdeğin dışında, pozitif yüke eşit sayıda elektronlar bulunur.
3. Nötr bir atomun çekirdeğinde 15 proton ve 16 nötron bulunmaktadır. Buna göre atomun, atom numarası ve kütle numarası kaçtır?
- Cevap: Nötr bir atom olduğuna göre;
proton sayısı= elektron sayısı
Proton sayısı: 15
Elektron sayısı: 15
Nötron sayısı: 16
Atom numarası nedir?
Atom numarası bir atomda bulunan proton sayısına eşittir.
Bu yüzden bu bize verilen atomda 15 proton olduğuna göre atom numarası 15 olur.
Kütle numarası nedir?
Kütle numarası atomun proton ve nötron sayılarının toplamıdır. Çünkü proton ve nötronların kütlesi elektronların kütlesinden çok daha büyüktür.
İşte bu yüzden bize verilen atomda 15 ve 16 sayılarının toplamı yani 31 olarak bulunacaktır.
4. Aşağıdaki ikili atom gruplarını izotop, izobar, izoton veya izoelektronik olarak belirtiniz.
a) 7Li+- He b) ??Na – ?^Mg c) 19F – 10Ne ç) 16C – 16C
- Cevap: A şıkkında protonları aynı olduğu için izotop, B şıkkında ikisinin de elektronları 18 olduğu için izoelektronik, C şıkkında kütle numaraları aynı olduğu için izobar, Ç şıkkında ise ikisinin de nötronları 18 yani eşit olduğu için izotondur.
5. Aşağıda verilen atomların periyodik tablodaki yerini belirleyiniz.
a) 6C
b) SF
c) 13AI
ç) 20Ca
- Cevap:

6. Aşağıda verilen ikili atomları, atom yarıçaplarının büyüklüğüne göre karşılaştırınız.
a) 10Ne –
11Na
b) 12Mg – 16S
- Cevap:
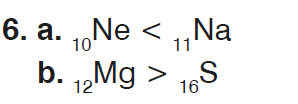
7. Aşağıda verilen ikili atomları, birinci iyonlaşma enerjilerinin büyüklüğüne göre karşılaştırınız.
a) 12Mg – 17Cl
b) Na – 1SK
- Cevap: K >Cl; Al >Mg
Açıklama: K bir elektron verirse 8A olur Cl verirse 6A olur 8A nın iyonlaşma enerjisi 6A dan fazladır o yüzden K > Cl. 2. de ise Mg bir elektron verirse 1A olur Al ise 2A olur 2A nın iyonlaşma enerjisi 1A dan daha büyüktür o yüzden Al>Mg 8. Periyodik tabloda, periyot ve grup boyunca element atomlarının metalik-ametalik özelliklerinin değişimini açıklayınız.
- Cevap: Periyodik tabloda yer alan düşey sıralara grup veya sütun adı verilir. 8 tane A ve 10 tane B grubu (8B grubu üç tanedir) bulunmaktadır. Elementlerin değerlik elektron sayısı ise grup numarasını vermektedir. Periyodik tabloda yer alan aynı periyotta bulunan elementlerin soldan sağa doğru gidildikçe metalik özellik azalırken ametalik özellik artmaktadır. Çünkü periyodik tablonun sol tarafında metaller bulunurken sağ tarafında ametaller bulunmaktadır. İyonlaşma enerjisi genellikle artmaktadır. Periyodik tabloda yer alan aynı grupta bulunan elementlerin yukarıdan aşağıya doğru inildikçe metalik özellik artarken ametalik özellik azalmaktadır. Çünkü atom çapı büyük olan element daha kolay elektron vermektedir. Dolayısı ile aynı grupta bulunan elementlerin yukarıdan aşağıya doğru inildikçe atom çapı artmakta elektron verme eğilimi de artmaktadır. Değerlik elektron sayıları az olan metallerin iyonlaşma enerjisi de düşüktür.
Aşağıda, periyodik tabloda yer alan bazı elementler ve ifadeler verilmiştir. İfadeler, periyodik tablodaki hangi elementler için geçerli ise ifadenin yanına o elementlerin sembollerini yazınız.
- Cevap:
a) Metaldir (Mg, K, Zn)
b) Ametaldir (H, N, F, Cl)
c) Yarı metaldir (B, Si)
ç) Asal gazdır (He, Ar)
d) Geçiş metalidir (He, Ar)
e) Toprak alkali metaldir. (Mg)
f) 3A grubu elementidir. (Mg)
g) 2. periyot elementidir. (B, N, F)
h) Elektron dağılımı; 2 ) 8 ) 8 ) 1’dir. (K)
ı) Atomda; A = 40, n = 22’dir. (Ar)
i) Değerlik elektron sayısı 7’dir. (F, Cl)
j) Atom yarıçapı en büyüktür. (K)
k) İyonlaşma enerjisi en büyüktür. (He)
l) Elektronegatifliği en büyüktür. (F)
m) Elektron ortaklaşması yapar. (H, N, F, Cl)
n) Metalik özelliği en fazladır.. (K)
“9. Sınıf Kimya Ders Kitabı Cevapları Sonuç Yayınları Sayfa 81” ile ilgili aşağıda bulunan emojileri kullanarak duygularınızı belirtebilir aynı zamanda sosyal medyada paylaşarak bizlere katkıda bulunabilirsiniz.




















