9. Sınıf Kimya Ders Kitabı Sayfa 126 Cevapları Evrensel İletişim Yayınları’na ulaşabilmek ve dersinizi kolayca yapabilmek için aşağıdaki yayınımızı mutlaka inceleyiniz.
9. Sınıf Kimya Evrensel İletişim Yayınları Ders Kitabı Cevapları Sayfa 126
4. Aşağıda verilen cümlelerdeki noktalı yerleri uygun ifadelerle tamamlayınız.,
a. HF, H2O, NH3 gibi bileşiklerde moleküller arasındaki zayıf çekim kuvvetlerinden etkin olanı hidrojen bağıdır.
Açıklama: London kuvvetleri, dipol – dipol etkileşimleri ve hidrojen bağı gibi zayıf etkileşimleri bulunduran NH3, HF ve H2O gibi bileşiklerde hidrojen bağı etkindir.
b. Oluşturduğu hidrojen bağı sayesinde H2O bileşiğinin kaynama noktası H2S bileşiğinden çok büyüktür.
Açıklama: Moleküller arasındaki çekim kuvvetleri ne kadar büyük olursa bileşiğin erime noktası, kaynama noktası gibi fiziksel özellikleri de o kadar yüksek olur. Bir moleküldeki polarlık ne kadar fazla ise diğer moleküllerle arasında oluşan dipol-dipol etkileşimi o kadar büyük olur. Dipol-dipol etkileşiminin artması ile bileşiğin erime veya kaynama noktası da artacaktır.
c. Periyodik sistemde 18. grup elementleri olan asal gazlarda atom numarası arttıkça London kuvvetleri ve kaynama noktası da artar.
Açıklama: Asal gazlarda ve apolar kovalent moleküllerde elektron yoğunluğu arttıkça yoğun fazlarda geçici dipollerin oluşması daha kolay olur. Bunun için asal gazlarda atom numarası arttıkça kaynama noktası da artar. Asal gazlar ve apolar yapılı kovalent moleküllerin katı veya sıvı hâllerinde geçici dipoller oluşur. Oluşan bu geçici dipoller arasında London kuvvetleri oluşur.
ç. C2H6 bileşiğinde sıvı hâlde Wan der Walls kuvvetleri etkindir.
Açıklama: Bu soru normalde yanlış verilmiştir. Sıvı halde etan molekülleri arasında London kuvvetleri etkinken, moleküller arasındaki en etkin kuvvet Wan der Walls kuvvetleridir. Biz en güçlü kuvvet olarak wan der walls’ı seçtik, London Kuvvetleri cevabı da doğru olacaktır.
d. BF3 molekülü apolar, PH3 molekülü ise polar yapıdadır.
5. NH3 molekülleri arasında;
I. Dipol – dipol etkileşimi
II. London kuvveti
III. Hidrojen bağı
zayıf etkileşimlerinden hangisi ya da hangieri bulunur? (1H, 7N)
A) Yalnız I
B) I ve II
C) I ve III
D) II ve III
E) I, II ve III
- Cevap: E
Açıklama: H2O, NH3 ve HF gibi bileşik moleküllerinde bulunan hidrojen atomları N, O veya F atomlarından birisine bağlı olduğu için bu moleküller hidrojen bağları oluşur. Polar yapılı moleküllerde, molekülün zıt kutupları arasında oluşan elektrostatik çekim kuvveti dipol dipol etkileşimidir. H2O, H2S, NH3, HCl, HCN, PH3 gibi polar karakterli kovalent moleküllerde dipol-dipol etkileşimi görülür. Asal gazların ve apolar moleküllerin yoğun fazlarında sadece London kuvvetleri bulunur ve fiziksel özellikler de etkilidir. Polar moleküllerde London kuvvetleri ve dipol – dipol etkileşimleri bulunmasına rağmen kaynama noktasında dipol – dipol etkileşimi etkindir. London kuvvetleri, dipol – dipol etkileşimleri ve hidrojen bağı gibi zayıf etkileşimleri bulunduran NH3, HF ve H2O gibi bileşiklerde ise kaynama noktası gibi fiziksel özelliklerde hidrojen bağı etkindir.
6. Aşağıda kimyasal formülleri verilen bileşiklerin yoğun hâllerinin hangisinde sadece London kuvvetleri bulunur? (1H, 6C, 7N, 8O, 9F, 16S)
A) NH3
B) H2O
C) HF
D) SO2
E) CO2
- Cevap: E
Açıklama: 4A grubu elementlerinin hidrojenli bileşikleri olan CH4, SiH4, GeH4 ve SnH4 molekülleri apolar karakterlidir. Kendi molekülleri arasında sadece London kuvvetleri bulunduğundan diğer gruplardaki bileşiklere göre kaynama noktaları düşüktür. 4A grubu bileşiklerinde elektron yoğunluğu arttıkça London kuvvetleri arttığından CH4, SiH4, GeH4 ve SnH4 sıralamasında bileşiğin kaynama noktasında artış gözlenir.
Asal gazların ve apolar moleküllerin yoğun fazlarında sadece London kuvvetleri bulunur ve fiziksel özellikler de etkilidir. Yukarıdaki seçeneklerde yalnızca CO2 apolardır, diğerleri polardır. Polar moleküllerde London kuvvetleri ve dipol – dipol etkileşimleri bulunmasına rağmen kaynama noktasında dipol – dipol etkileşimi etkindir. London kuvvetleri, dipol – dipol etkileşimleri ve hidrojen bağı gibi zayıf etkileşimleri bulunduran NH3, HF ve H2O gibi bileşiklerde ise kaynama noktası gibi fiziksel özelliklerde hidrojen bağı etkindir.
CO2 gibi apolar yapılı bileşik moleküllerinin yapısında yoğun fazlarda geçici dipol yapı oluşur. Bu geçici dipol yapı, türler arasında bir çekim kuvveti oluşmasını sağlar. Geçici dipol yapıdan dolayı oluşan çekim kuvvetleri indüklenmiş dipol-indüklenmiş dipol etkileşimleri veya London kuvvetlerini oluşturur.
7. X, Y ve Z molekülleri için aşağıdaki bilgiler veriliyor.
• X moleküllerinde London kuvvetleri etkindir.
• Y molekülleri kalıcı dipol oluşturmaktadır.
• Z molekülleri hidrojen bağı oluşturmaktadır.
Buna göre X, Y ve Z molekülleri aşağıdakilerden hangisinde doğru verilmiş olabilir?
- Cevap: D
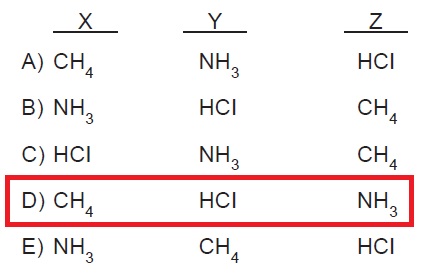
Açıklama: CH4, CO2 gibi apolar yapılı bileşik moleküllerinin yapısında yoğun fazlarda geçici dipol yapı oluşur. Bu geçici dipol yapı, türler arasında bir çekim kuvveti oluşmasını sağlar. Geçici dipol yapıdan dolayı oluşan bu çekim kuvvetleri London kuvvetleridir.
Kalıcı dipol yapının oluşması için molekülün polar karakterde olması gerekir. Polar kovalent bağ içeren iki atomlu moleküllerde kalıcı dipoller vardır. HF, HCl, HBr gibi moleküller polar karakterdedir ve kalıcı dipoller içerir. HCl molekülünde Cl– iyonu negatif, H+ iyonu pozitif yüklüdür. HCl molekülü kalıcı dipoller içeren polar bir moleküldür.
London kuvvetleri, dipol – dipol etkileşimleri ve hidrojen bağı gibi zayıf etkileşimleri bulunduran NH3, HF ve H2O gibi bileşiklerde ise kaynama noktası gibi fiziksel özelliklerde hidrojen bağı etkindir. Ancak elektron sayısı çok olan apolar moleküllerde London kuvvetleri, dipollüğü yüksek olan polar moleküllerde de dipol – dipol etkileşimleri önem kazanır.
8. I. Kovalent bağ
II. Metalik bağ
III. Hidrojen bağı
Yukarıda verilen etkileşimlerden hangisi ya da hangileri yoğun hâlde moleküller arasında bulunan etkileşimdir?
A) Yalnız I
B) Yalnız III
C) I ve II
D) II ve III
E) I, II ve III
- Cevap: A
Açıklama: He, Ne, Ar gibi asal gazların; F2, Cl2, Br2, N2, O2, H2 gibi apolar element moleküllerinin ve CH4, CO2 gibi apolar yapılı bileşik moleküllerinin yapısında yoğun fazlarda geçici dipol yapı oluşur. Asal gazlarda ve apolar kovalent moleküllerde elektron yoğunluğu arttıkça yoğun fazlarda geçici dipollerin oluşması daha kolay olur. Yoğun halde sorulduğu için cevap Kovalent bağ’dır.
9. Sınıf Evrensel İletişim Yayınları Kimya Ders Kitabı Sayfa 126 Cevabı ile ilgili aşağıda bulunan emojileri kullanarak duygularınızı belirtebilir aynı zamanda sosyal medyada paylaşarak bizlere katkıda bulunabilirsiniz.




















