“11. Sınıf Kimya Ders Kitabı Sayfa 268 Cevapları Meb Yayınları” ulaşabilmek ve dersinizi kolayca yapabilmek için aşağıdaki yayınımızı mutlaka inceleyiniz.
11. Sınıf Meb Yayınları Kimya Ders Kitabı Sayfa 268 Cevabı
Aşağıdaki metinde boş bırakılan yerleri uygun sözcüklerle doldurunuz. Verilen soruları yanıtlayınız.
- Cevap: (a) kimyasal denge, (b) denge sabiti, (c) Kc, (ç) Kp, (d) Le Chatalier, (e) sıcaklık, (f) basınç, (g) derişim, (h) azaltacak, (ı) oto-iyonizasyon, (i) hidrojen, (j) hidroksit, (k) pH, (l) pOH, (m) Brönsted-Lowry, (n) eşlenik, (o) kuvvetli, (ö) zayıf, (p) asitlik, (r) bazlık, (s) tampon, (ş) nötralleşme, (t) titrasyon, (u) indikatör, (ü) çözünürlük çarpımı,
Belirli koşullardaki kimyasal tepkimede, tepkimeye girenlerin ve ürünlerin derişimlerinin zamanla değişim göstermediği duruma (a) kimyasal denge denir. Tersinir bir tepkimede denge anında ürünlerin derişimlerinin tepkimeye girenlerin derişim oranına (b) denge sabiti denir. Derişimler cinsinden denge sabiti (c) Kc ile, kısmi basınçlar cinsinden denge sabiti ise(ç) Kp şeklinde gösterilir. (d) Le Chatalier İlkesi’ne göre dengedeki sisteme dışarıdan (e) sıcaklık, (f) basınç, (g) derişim değişikliği yapıldığında sistem tekrar dengeye ulaşıncaya kadar bu etkiyi (h) azaltacak yönde eğilim gösterir. Su molekülü de kendi iyonlarıyla denge hâlindedir. Suyun iyonlarına ayrışmasına (ı) oto-iyonizasyon denir. Saf su ayrıştığında oluşan (i) hidrojen iyonu ve (j) hidroksit iyonu tüm sulu çözeltilerde bulunur. [H+]’nin negatif logaritmasına (k) ve [OH-]’in negatif logaritmasına (l) pOH denir ve bu iyonların derişimi çözeltinin asidik, bazik veya nötr olarak değerlendirilmesini sağlar. (m) Brönsted-Lowry tanımına göre proton (H+) veren maddeler asit, proton (H+) alan maddeler bazdır ve asit-baz tepkimelerinde proton, asitten baza transfer edilir. Aralarında bir proton farkı olan asit-baz çiftine (n) eşlenik asit-baz çifti denir. Suda çözündüğünde %100 iyonlaştığı varsayılan asit-baza (o) kuvvetli, suda kısmen iyonlaştığı varsayılan asit-baza (o) zayıf asit-baz denir. Zayıf asit ve bazların iyonlarına ayrışma denge sabitlerine sırasıyla (p) asitlik sabiti ve (r) bazlık sabiti denir. Bu denge sabitleri sırasıyla Ka ve K şeklinde gösterilir. Az miktarda asit veya baz eklenmesi ile pH değişimine direnç gösteren ve zayıf konjuge asit veya baz çiftlerini içeren çözeltilere (s) tampon çözelti denir. Bir asit ile baz çözeltisi karıştırıldığında asitten gelen H+ iyonunun mol sayısı ile bazdan gelen OH- iyonu mol sayısı eşit olduğunda (ş) nötralleşme gerçekleşir. Derişimi bilinen asit veya bazı kullanarak derişimi bilinmeyen asit veya bazın derişimini bulmak için yavaş yapılan nötralleşme işlemine (t) titrasyon denir ve çözeltinin nötralleşme anını tespit etmek için (u) indikatör kullanılır. Bir tuzun suda çözünmesi sırasında da denge oluşur. 25 oC’ta suda az çözünen tuzların doygun çözeltilerindeki denge sabitine (u) çözünürlük çarpımı denir ve Kçç sembolü ile gösterilir. Bu değer çözünen maddeye ve sıcaklığa bağlıdır.
1. Tepkimedeki girenlerin ve ürünlerin miktarının sabit kalabilmesi ve tepkimenin denge hâlinden söz edebilmek için hangi şartlar olmalıdır?
- Cevap: kapalı kap, sabit sıcaklık
2. Maksimum düzensizlik ve minimum enerji eğilimi nedir? Açıklayınız.
- Cevap: maksimum düzensizlik: aralarındaki etkileşimin en az olması, minimum enerji: düşük enerjili durum
3. Sistem dengeye gelmeden önce ve denge anında ileri ve geri tepkime hızları nasıl değişir?
- Cevap: Dengeye gelmeden ileri tepkime hızı fazladır, zamanla azalır. Geri tepkime hızı
düşüktür, zamanla artar. Dengede eşitlenir
4. 2N2O(g) + 3O2(g) ^=5: 4NO2(g) denge tepkimesi için
a) Derişimler cinsinden denge sabitini yazınız.
b) Kısmi basınçlar cinsinden denge sabitini yazınız.
c) İki denge sabiti arasındaki ilişkiyi yazınız.
- Cevap:
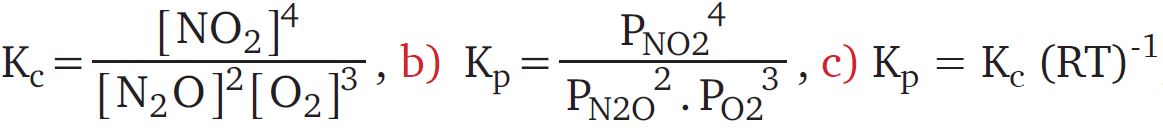
“11. Sınıf Kimya Ders Kitabı Cevapları Meb Yayınları Sayfa 268” ile ilgili aşağıda bulunan emojileri kullanarak duygularınızı belirtebilir aynı zamanda sosyal medyada paylaşarak bizlere katkıda bulunabilirsiniz.




















